- AFFINITÉ (thermodynamique)
- AFFINITÉ (thermodynamique)AFFINITÉ, thermodynamiqueLa notion d’affinité chimique est relativement ancienne. On la rencontre déjà, bien que sous un aspect encore purement qualitatif, dans les spéculations des alchimistes sur la transmutation des métaux au Moyen Âge (Albert le Grand, 1193-1280). Quant au terme lui-même, il semble avoir été introduit en chimie vers 1773 par le Hollandais Boerhaave de Leyde.Il faut attendre ensuite la seconde moitié du XIXe siècle pour assister à un premier essai d’interprétation quantitative, avec l’hypothèse du chimiste français Marcelin Berthelot. En effet, pour ce dernier, la chaleur dégagée par une réaction chimique devait être la mesure de l’affinité de ses divers constituants initiaux.Toutefois, la contradiction résultant de l’existence de réactions à caractère endothermique fit échouer cette tentative. Elle subsiste néanmoins au titre d’approximation acceptable à basse température.Une définition correcte et complète a été fournie par le savant belge Théophile De Donder et publiée dans le Bulletin de l’Académie royale de Belgique en mai 1922. Cette fois, le point de vue adopté est essentiellement basé sur le second principe de la thermodynamique. Celui-ci assigne en effet une orientation à tout processus de non-équilibre , par l’intermédiaire du signe positif imposé à la production d’entropie, ou indifféremment, à la chaleur non compensée d Qn , fournie par l’inégalité de Carnot-Clausius:
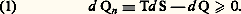 Dans cette relation dS désigne l’accroissement d’entropie consécutif à la quantité élémentaire d Q de chaleur reçue par le milieu envisagé, et T la température absolue de Kelvin.Ayant pour objet les évolutions chimiques, De Donder introduit d’abord l’intermédiaire de la loi dite des proportions définies de Dalton:
Dans cette relation dS désigne l’accroissement d’entropie consécutif à la quantité élémentaire d Q de chaleur reçue par le milieu envisagé, et T la température absolue de Kelvin.Ayant pour objet les évolutions chimiques, De Donder introduit d’abord l’intermédiaire de la loi dite des proportions définies de Dalton: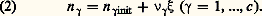 Cette loi exprime que les quantités variables n j, qui désignent le nombre de moles des c constituants du système, dépendent de la seule variable chimique 﨡 . Les coefficients stoechiométriques 猪 size=1塚j sont positifs ou négatifs selon qu’ils concernent un constituant formé ou consommé au cours de la réaction considérée. L’étude du comportement d’un processus chimique constitue donc, en général, un problème à trois variables, dont deux physiques, comme la température T et la pression p , et une chimique 﨡 . De la même façon, un système de r réactions chimiques, linéairement indépendantes, exige r variables chimiques distinctes:
Cette loi exprime que les quantités variables n j, qui désignent le nombre de moles des c constituants du système, dépendent de la seule variable chimique 﨡 . Les coefficients stoechiométriques 猪 size=1塚j sont positifs ou négatifs selon qu’ils concernent un constituant formé ou consommé au cours de la réaction considérée. L’étude du comportement d’un processus chimique constitue donc, en général, un problème à trois variables, dont deux physiques, comme la température T et la pression p , et une chimique 﨡 . De la même façon, un système de r réactions chimiques, linéairement indépendantes, exige r variables chimiques distinctes: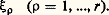 La vitesse de réaction se définit ensuite au moyen de la dérivée par rapport au temps du degré d’avancement, soit v = d 﨡dt . Dès lors, on déduit de l’inégalité (1), la condition:
La vitesse de réaction se définit ensuite au moyen de la dérivée par rapport au temps du degré d’avancement, soit v = d 﨡dt . Dès lors, on déduit de l’inégalité (1), la condition: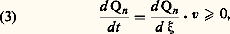 dans laquelle le signe du premier facteur détermine celui du second et caractérise ainsi le sens adopté par la réaction considérée. Néanmoins, avant de pouvoir attribuer pour cette raison un rôle d’affinité au premier facteur, il importe au préalable d’établir sa signification comme propriété du milieu envisagé. En d’autres termes, il reste à prouver que d Qn /d 﨡 caractérise une fonction d’état de ce milieu.On atteint ce résultat en procédant au développement des expressions différentielles d S et d Q = d H — Vdp , où H désigne l’enthalpie du système conformément au premier principe de conservation de l’énergie, V son volume et p sa pression. Adoptant par exemple les variables indépendantes T, p , 﨡, l’inégalité (1) prend la forme:
dans laquelle le signe du premier facteur détermine celui du second et caractérise ainsi le sens adopté par la réaction considérée. Néanmoins, avant de pouvoir attribuer pour cette raison un rôle d’affinité au premier facteur, il importe au préalable d’établir sa signification comme propriété du milieu envisagé. En d’autres termes, il reste à prouver que d Qn /d 﨡 caractérise une fonction d’état de ce milieu.On atteint ce résultat en procédant au développement des expressions différentielles d S et d Q = d H — Vdp , où H désigne l’enthalpie du système conformément au premier principe de conservation de l’énergie, V son volume et p sa pression. Adoptant par exemple les variables indépendantes T, p , 﨡, l’inégalité (1) prend la forme: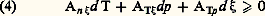 où les coefficients A sont des fonctions de ces variables.Pour De Donder, la seule cause possible d’irréversibilité au sein d’un système uniforme provient des effets chimiques. Dès lors, on doit avoir les égalités:
où les coefficients A sont des fonctions de ces variables.Pour De Donder, la seule cause possible d’irréversibilité au sein d’un système uniforme provient des effets chimiques. Dès lors, on doit avoir les égalités: déjà vérifiées pour les systèmes physiques à deux variables. Ensuite, l’intervention de cette propriété dans les divers changements de variables physiques T, p , 﨡,T, V, 﨡, ...x , y , 﨡, fait apparaître directement le caractère cherché de fonction d’état , grâce à l’invariance constatée:
déjà vérifiées pour les systèmes physiques à deux variables. Ensuite, l’intervention de cette propriété dans les divers changements de variables physiques T, p , 﨡,T, V, 﨡, ...x , y , 﨡, fait apparaître directement le caractère cherché de fonction d’état , grâce à l’invariance constatée: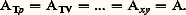 Le second principe de la thermodynamique prend ainsi la forme obtenue par De Donder:
Le second principe de la thermodynamique prend ainsi la forme obtenue par De Donder: où A désigne l’affinité du système puisque cette fonction implique par son signe celui de la vitesse de réaction et par conséquent le sens de l’évolution envisagée .Sa valeur déduite de (1) est donnée par l’une des relations:
où A désigne l’affinité du système puisque cette fonction implique par son signe celui de la vitesse de réaction et par conséquent le sens de l’évolution envisagée .Sa valeur déduite de (1) est donnée par l’une des relations: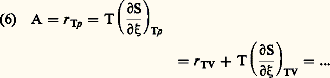 où 精 size=1糖神 et 精TV sont respectivement les chaleurs de réactions dégagées à T, p et à T V constants. Le terme correctif de l’hypothèse initiale introduite par Berthelot apparaît ici explicitement.Pour un système comportant r réactions chimiques distinctes, c’est-à-dire linéairement indépendantes, l’inégalité (5) se généralise sous la forme bilinéaire:
où 精 size=1糖神 et 精TV sont respectivement les chaleurs de réactions dégagées à T, p et à T V constants. Le terme correctif de l’hypothèse initiale introduite par Berthelot apparaît ici explicitement.Pour un système comportant r réactions chimiques distinctes, c’est-à-dire linéairement indépendantes, l’inégalité (5) se généralise sous la forme bilinéaire: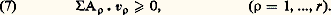 Quant à la condition d’équilibre, elle correspond au signe d’égalité, soit A size=1福 = 0, dont la forme explicite n’est autre que la loi d’action des masses de Guldberg et Waage.Dans la somme ci-dessus, certains termes peuvent présenter une valeur négative par suite d’effets de couplage, pourvu que dans son ensemble l’inégalité (7) soit finalement respectée. Cette inégalité, mais de signe opposé, avait déjà été obtenue antérieurement par Pierre Duhem comme l’expression d’un frottement chimique. Cependant, un tel rapprochement est purement formel, car la relation de Duhem ne fait aucune allusion à la propriété essentielle de fonction d’état introduite pour l’affinité par De Donder, et qui confère à cette grandeur toute son originalité.Enfin, l’inégalité de Carnot-Clausius conduit directement aux relations entre l’affinité et les principales fonctions thermodynamiques. On obtient notamment, dans le cas d’une seule réaction pour l’enthalpie H, l’égalité:
Quant à la condition d’équilibre, elle correspond au signe d’égalité, soit A size=1福 = 0, dont la forme explicite n’est autre que la loi d’action des masses de Guldberg et Waage.Dans la somme ci-dessus, certains termes peuvent présenter une valeur négative par suite d’effets de couplage, pourvu que dans son ensemble l’inégalité (7) soit finalement respectée. Cette inégalité, mais de signe opposé, avait déjà été obtenue antérieurement par Pierre Duhem comme l’expression d’un frottement chimique. Cependant, un tel rapprochement est purement formel, car la relation de Duhem ne fait aucune allusion à la propriété essentielle de fonction d’état introduite pour l’affinité par De Donder, et qui confère à cette grandeur toute son originalité.Enfin, l’inégalité de Carnot-Clausius conduit directement aux relations entre l’affinité et les principales fonctions thermodynamiques. On obtient notamment, dans le cas d’une seule réaction pour l’enthalpie H, l’égalité: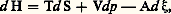 ainsi que pour l’enthalpie libre G, l’égalité:
ainsi que pour l’enthalpie libre G, l’égalité: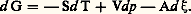 Par suite, la relation entre l’affinité et les potentiels chimiques molaires de Gibbs 猪 prend la forme:
Par suite, la relation entre l’affinité et les potentiels chimiques molaires de Gibbs 猪 prend la forme: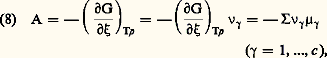 généralement utilisée dans les applications à la théorie de l’équilibre thermodynamique. Le calcul de l’affinité moyenne et la notation correspondante utilisée par G. N. Lewis et M. Randall s’en déduisent directement.Quant au critère de stabilité de l’équilibre chimique, il prend la forme très compacte:
généralement utilisée dans les applications à la théorie de l’équilibre thermodynamique. Le calcul de l’affinité moyenne et la notation correspondante utilisée par G. N. Lewis et M. Randall s’en déduisent directement.Quant au critère de stabilité de l’équilibre chimique, il prend la forme très compacte: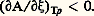 Les inégalités (5) et (7) de De Donder constituent la première étape dans le développement de la thermodynamique non linéaire, à la suite de l’extension de la méthode aux diverses autres causes d’irréversibilité (diffusion, viscosité...) que la réaction chimique, avec pour aboutissement la notion de structures dissipatives .En résumé, l’affinité chimique représente une mesure en calories, non plus d’une chaleur de réaction, mais d’une expression plus générale qui traduit, dans tous les cas, la tendance à l’évolution du système chimique .
Les inégalités (5) et (7) de De Donder constituent la première étape dans le développement de la thermodynamique non linéaire, à la suite de l’extension de la méthode aux diverses autres causes d’irréversibilité (diffusion, viscosité...) que la réaction chimique, avec pour aboutissement la notion de structures dissipatives .En résumé, l’affinité chimique représente une mesure en calories, non plus d’une chaleur de réaction, mais d’une expression plus générale qui traduit, dans tous les cas, la tendance à l’évolution du système chimique .
Encyclopédie Universelle. 2012.
